
Las propiedades del átomo son intrínsecas a su estructura subatómica y determinan su identidad química, reactividad y respuesta a la energía, fundamentales para comprender la materia y sus transformaciones.
Aunque no somos capaz de verlos a simple vista, los átomos forman parte de toda la materia de nuestro planeta. Toda la materia está hecha de átomos, que se agrupan para formar elementos químicos, moléculas, compuestos, etc. Se define el átomo como la unidad básica más pequeña de la materia que tiene las propiedades de un elemento químico. Cada elementos químico viene definido por el tipo de átomo del que está formado, por lo que la pregunta final es: ¿qué propiedades tiene el átomo?
En esta lección de unPROFESOR repasaremos las propiedades del átomo que hacen que cada átomo sea característico un elemento químico.
¿Qué es el átomo?
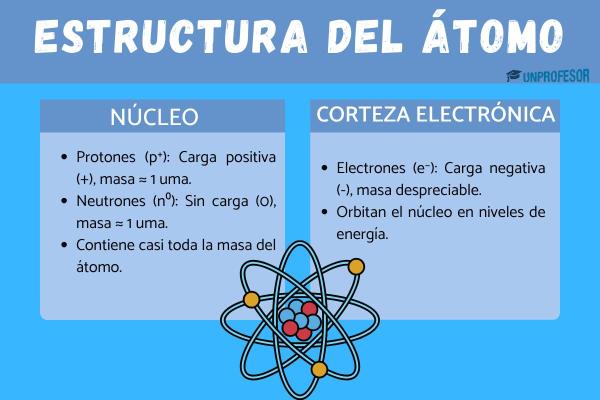
Antes de entrar a analizar las propiedades del átomo es importante que conozcamos mejor de qué se trata. El átomo es una unidad formada por tres partículas subátomicas: protones, neutrones y electrones. Estos están organizados en núcleo y corteza.
- El núcleo está formado por protones y neutrones, que está en el centro del átomo, y es el responsable de la mayoría del peso del átomo; los protones están cargados positivamente, mientras que los neutrones son neutros por lo que el núcleo está cargado positivamente.
- La corteza está formada por lo electrones, que son partículas pequeñas, cargadas negativamente que giran alrededor del núcleo formando órbitas (como la de los planetas) pero sin llegar a caer nunca al núcleo del átomo. La corteza del átomo es la encargada de interaccionar con la corteza de los demás átomos ya que se encuentra en la parte exterior de los átomos.
Los diferentes átomos están formados por protones, neutrones y electrones, iguales en todos los elementos químicos. Entonces, ¿qué hace que haya diferentes elementos químicos? El número de protones, neutrones y electrones del que están compuestos los átomos de cada elemento es diferente y esto a su vez hace que cada elemento tenga unas características u otras.

¿Cuáles son las propiedades del átomo?
El átomo, la unidad más pequeña de un elemento químico que conserva sus propiedades, es un sistema complejo gobernado por los principios de la mecánica cuántica. Las propiedades del átomo derivan de la interacción y distribución de sus constituyentes subatómicos: protones, neutrones y electrones.
- Composición y estructura. El átomo se compone de un núcleo atómico denso y cargado positivamente, que contiene protones (carga +1e) y neutrones (sin carga neta), y una envoltura de electrones (carga −1e) que orbitan el núcleo. La masa del átomo se concentra predominantemente en el núcleo, mientras que su volumen está definido por la región de probabilidad de los electrones.
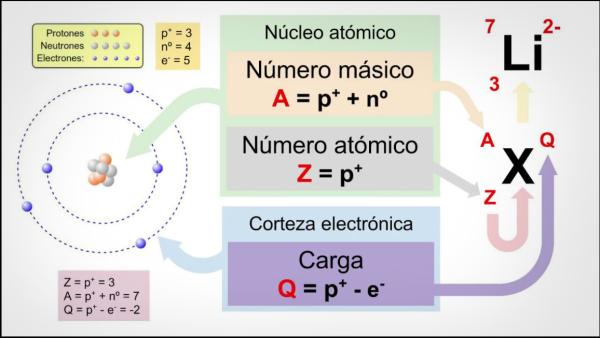
- Número Atómico (Z) y Masa Atómica (A). El número atómico (Z) define la identidad de un elemento y es igual al número de protones en el núcleo. En un átomo neutro, el número de electrones es igual al número de protones. La masa atómica (A) de un isótopo particular se aproxima por la suma del número de protones y neutrones en su núcleo.
- Isótopos. Los isótopos son átomos del mismo elemento (mismo Z) que difieren en el número de neutrones y, por lo tanto, en su masa atómica (A). Las propiedades químicas de los isótopos de un mismo elemento son prácticamente idénticas, aunque sus propiedades nucleares pueden variar significativamente (ej. estabilidad, radiactividad).
- Naturaleza cuántica de los electrones. Los electrones en el átomo no siguen órbitas planetarias clásicas. Su comportamiento se describe mediante orbitales atómicos, que son regiones de probabilidad donde es más probable encontrar un electrón. La energía de los electrones está cuantizada, lo que significa que solo pueden ocupar niveles de energía discretos. Las transiciones entre estos niveles implican la absorción o emisión de fotones de energía específica.
- Configuraciones electrónicas y reactividad química. La configuración electrónica, que describe la distribución de los electrones en los diferentes orbitales y niveles de energía, determina las propiedades químicas de un átomo. Los electrones de la capa más externa (electrones de valencia) son los responsables de la formación de enlaces químicos, lo que explica la capacidad de los átomos para combinarse y formar moléculas.
- Fuerzas intratómicas. Dentro del átomo operan fundamentalmente tres de las cuatro fuerzas fundamentales: Fuerza electromagnética, que es la responsable de la atracción entre el núcleo positivo y los electrones negativos, así como de la repulsión entre protones. Es la fuerza que define la estructura electrónica del átomo; Fuerza nuclear fuerte, que es la fuerza más potente y de corto alcance, responsable de mantener unidos los protones y neutrones en el núcleo, superando la repulsión electromagnética entre protones; Fuerza nuclear débil, implicada en ciertos tipos de desintegración radiactiva, como la desintegración beta, donde un protón se convierte en un neutrón (o viceversa).
- Espectros atómicos. Los átomos tienen espectros de emisión y absorción característicos, resultado de las transiciones electrónicas cuantizadas. Cuando los electrones absorben energía, saltan a niveles superiores; al regresar a niveles de menor energía, emiten fotones con longitudes de onda específicas. Esta propiedad es fundamental para la identificación de elementos y el análisis de la composición de la materia.
- Propiedades magnéticas. Muchos átomos poseen momentos magnéticos debido al spin intrínseco de los electrones y, en algunos casos, de los núcleos. Esta propiedad es la base del paramagnetismo, diamagnetismo y ferromagnetismo en los materiales, y tiene aplicaciones importantes en técnicas como la Resonancia Magnética Nuclear (RMN).

El número atómico, el número másico y los isótopos
Las primeras tres características tienen que ver directamente con el número de partículas que forman el átomo de cada elemento.
El número atómico (Z) indica el número de protones que forman el núcleo de un átomo. Así, por ejemplo, todos los átomos de hierro tendrán 26 protones en su núcleo. Además, si no nos indican lo contrario, los elementos químicos se encuentran en estado neutro, es decir, la carga positiva (protones) y negativa (electrones) es la misma, por lo que todos ellos tendrán también 26 electrones.
El número másico o peso atómico (A) indica el número total de protones y neutrones que forman el núcleo de un átomo. Como ya hemos indicado antes, el peso de los electrones es prácticamente despreciable comparado con el de los protones y neutrones, por lo que el número másico nos indica de forma indirecta el peso del átomo en cuestión. Siguiendo con el ejemplo del hierro, si consultas la tabla periódica de los elementos verás que el peso atómico de este elemento es 55.85, lo que quiere decir que todos los átomos de ese elemento tendrán ese peso.
Por último, los isótopos de un elemento químico son variantes del mismo átomo (es decir, tienen el mismo número atómico) pero diferente número másico, es decir, diferente número de neutrones. La mayoría de elementos químicos tienen más de un isótopo natural, siendo el elemento con mayor cantidad de isótopos estables el Estaño (Sn), que tiene 10 isótopos naturales diferentes.
Densidad, otra de las propiedades del átomo
La densidad de un átomo es el número de unidades de masa (u.m.a) del elemento que están presentes en cierto volumen de espacio. La densidad de cualquier sustancia se simbolizada a través de la letra griega “ro” (escrita r) y sus unidades según el sistema internacional de unidades (SI) son los kilogramos por metro cúbico (kg/m3). En el caso de los elementos químicos, al ser tan pequeños se utiliza como unidades el gramo por centímetro cúbico (g/cm3).
Para calcular la densidad de un átomo (densidad atómica), tendríamos que tener en cuenta la masa del átomo y el volumen del mismo. Mientras que la mayoría de la masa del átomo se encuentra en el núcleo del mismo, el volumen tiene que ver con lo grande que es el átomo, y por lo tanto el número de orbitales electrónicos jugará un papel importante. Teniendo en cuenta dichas propiedades y su tendencia en el sistema periódico, podemos observar que la densidad aumenta conforme aumentamos en un grupo y aumenta también conforme nos acercamos a la parte central de la tabla periódica.
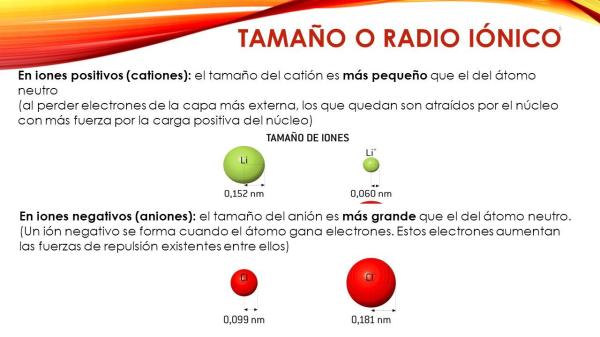
Radio iónico y radio de Vanderwalls
El radio iónico es el radio que tiene un ión de un elemento en estado de cristal iónico. En ese estado, los iones están tan juntos que los orbitales electrónicos más externos están en contacto unos con otros.
Por otro lado, el radio de Vanderwalls es la distancia a la que se mantienen separados dos átomos debido a la repulsión de cargas negativas que hay entre los electrones de cada uno de los átomos. El radio de Vanderwalls sería radio de una esfera sólida imaginaria empleada para modelizar el átomo por lo que no se utiliza mucho en la práctica diaria.
A diferencia de lo que ocurre con la densidad o la masa, estas dos propiedades están íntimamente relacionadas con el volumen del átomo, es decir, tienen más que ver con el número de electrones del mismo que con el núcleo.
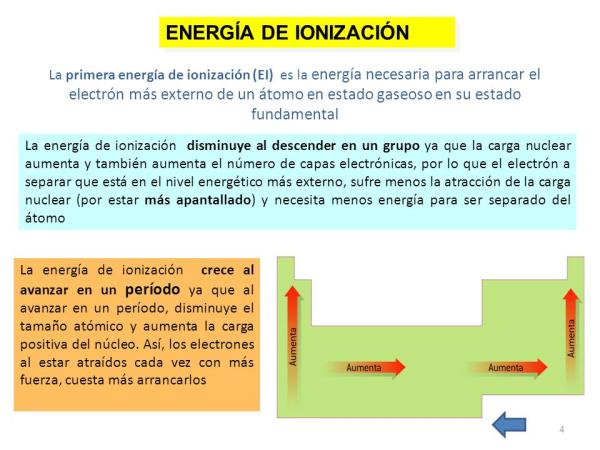
Energía de ionización
Por último, otra de las propiedades del átomo es la energía de ionización, una propiedad que nos dice la energía que necesitamos para separar un electrón en su estado fundamental (que no sea un anión o un catión) de un átomo de un elemento en estado gaseoso pero también se podría definir como la fuerza con la que un electrón se enlaza con otras moléculas. Esta propiedad es muy interesante ya que nos permite hacernos una idea aproximada de la capacidad de reaccionar de un átomo de determinado elemento químico. La energía de ionización es mayor según vamos quitando electrones, por lo que para un elemento hay una energía de primera ionización, una energía de segunda ionización, y así sucesivamente y van siendo cada vez mayores.
Al igual que en el caso anterior, esta propiedad también está íntimamente relacionada con el número de orbitales del elemento en cuestión ya que, cuantos menos orbitales tenga, más costará retirar los electrones de un átomo determinado.
¿Cuáles son las propiedades del núcleo del átomo?
El núcleo del átomo sería como el Sol: pequeño, pero con toda la fuerza. Está justo en el centro y contiene a los protones (con carga positiva) y a los neutrones (sin carga). Juntos, forman la parte más pesada del átomo.
- Una propiedad importante del núcleo es su carga positiva, que viene de los protones. Como los electrones que giran alrededor tienen carga negativa, la fuerza de atracción entre ambos es lo que mantiene al átomo unido.
- Otra cosa a destacar es que el núcleo es muy denso. Aunque su tamaño es diminuto comparado con todo el átomo, contiene casi toda la masa. Si el átomo fuera del tamaño de un estadio, el núcleo sería como una canica en el centro del campo.
- También hay que mencionar que dentro del núcleo actúa una fuerza especial: la fuerza nuclear fuerte. Es una de las cuatro fuerzas fundamentales de la naturaleza y es la que mantiene a los protones y neutrones bien pegados, a pesar de que los protones se repelen entre sí por tener la misma carga.
- Y no todos los núcleos son iguales. Algunos son estables, es decir, no cambian con el tiempo. Otros son inestables y se descomponen, liberando energía. Eso es lo que pasa, por ejemplo, con algunos elementos radiactivos.
Estructura del átomo
Aunque parezca una unidad simple, el átomo tiene una estructura muy bien organizada. Está formado por dos zonas principales:
- El núcleo, que como vimos, está en el centro y contiene protones y neutrones.
- La nube electrónica, que es el espacio que rodea al núcleo y donde se encuentran los electrones.
Los electrones no están pegados al núcleo, sino que se mueven a su alrededor en lo que se llaman orbitales, una especie de “zonas” donde es más probable encontrarlos. Cada electrón tiene un nivel de energía, y los que están más cerca del núcleo tienen menos energía que los que están más lejos.
Este comportamiento de los electrones es muy importante porque explica por qué algunos elementos se combinan fácilmente entre sí, mientras que otros no. También ayuda a entender por qué ciertas sustancias reaccionan con otras y cómo se forman los enlaces químicos.
Una forma muy conocida de representar esta estructura es el modelo de Bohr, donde los electrones giran en órbitas definidas alrededor del núcleo. Aunque no es 100% exacto según la física moderna, sigue siendo una buena forma de imaginar cómo están distribuidos los electrones.
Átomos: ejemplos
Ya sabes que todos los átomos tienen la misma estructura básica, pero lo que los hace diferentes es cuántos protones, neutrones y electrones tienen.
Cada uno de estos átomos tiene un lugar en la Tabla Periódica, que los organiza según su número atómico y sus propiedades químicas. Gracias a ella, los científicos pueden predecir cómo va a reaccionar un elemento, con qué otros se puede combinar, y qué compuestos pueden formarse.
Aquí te dejamos algunos ejemplos de átomos:
- Hidrógeno (H): Es el más simple de todos. Tiene un protón y un electrón, y normalmente ningún neutrón. Es el elemento más abundante en el universo y está presente en el agua (H₂O) y en muchas moléculas orgánicas.
- Oxígeno (O): Tiene 8 protones y normalmente 8 neutrones. Es esencial para la vida porque lo respiramos y porque forma parte del agua.
- Carbono (C): Tiene 6 protones y forma la base de toda la vida en la Tierra. Está en los seres vivos, en los alimentos, en los combustibles y hasta en los diamantes.
- Helio (He): Es un gas noble, lo que significa que no reacciona fácilmente con otros elementos. Tiene 2 protones y 2 electrones, y se usa en globos y en equipos de refrigeración.
- Hierro (Fe): Es un elemento metálico muy conocido. Tiene 26 protones y juega un papel fundamental en la sangre (en la hemoglobina) y en la industria.
- Sodio (Na): Tiene 11 protones, 11 electrones y normalmente 12 neutrones. Es un metal muy reactivo que forma parte de la sal común (cloruro de sodio, NaCl). En estado puro, reacciona rápidamente con el agua, liberando hidrógeno y generando calor.
Si deseas leer más artículos parecidos a Propiedades del átomo, te recomendamos que entres en nuestra categoría de El átomo.
- Thomson, G. P., & Carrera, M. P. (1958). El átomo. Vergara.
- Solbes, J. (2018). El modelo cuántico del átomo. Alambique: Didáctica de las ciencias experimentales, (93), 26-33.