Dónde se encuentran los electrones


Los electrones son partículas subatómicas que giran alrededor del núcleo atómico en una nube de electrones que recibe el nombre de corteza electrónica. En esta lección de unPROFESOR veremos dónde se encuentran los electrones dentro de la estructura atómica, así como el comportamiento de los electrones en los distintos estados del átomos (estado fundamental y de excitación), cuando los átomos forman iones monoátomicos y cuando los electrones no están ligados a ningún átomo en particular.
¿Qué son los electrones y dónde se encuentran?
Los electrones se encuentran dentro de los átomos que son las unidades más pequeñas que constituye la materia. Los átomos son indivisibles y su estructura y composición determina las características de los materiales.
Los átomos están formados por tres tipos de partículas subatómicas:
- Protones: son partículas con masa y carga positiva
- Neutrones: son partículas con masa y sin carga eléctrica
- Electrones: son partículas sin masa y carga negativa.
Los protones y los neutrones formas parte del núcleo del átomo, de forma que el núcleo atómico concentra toda la masa y la carga positiva del átomo.
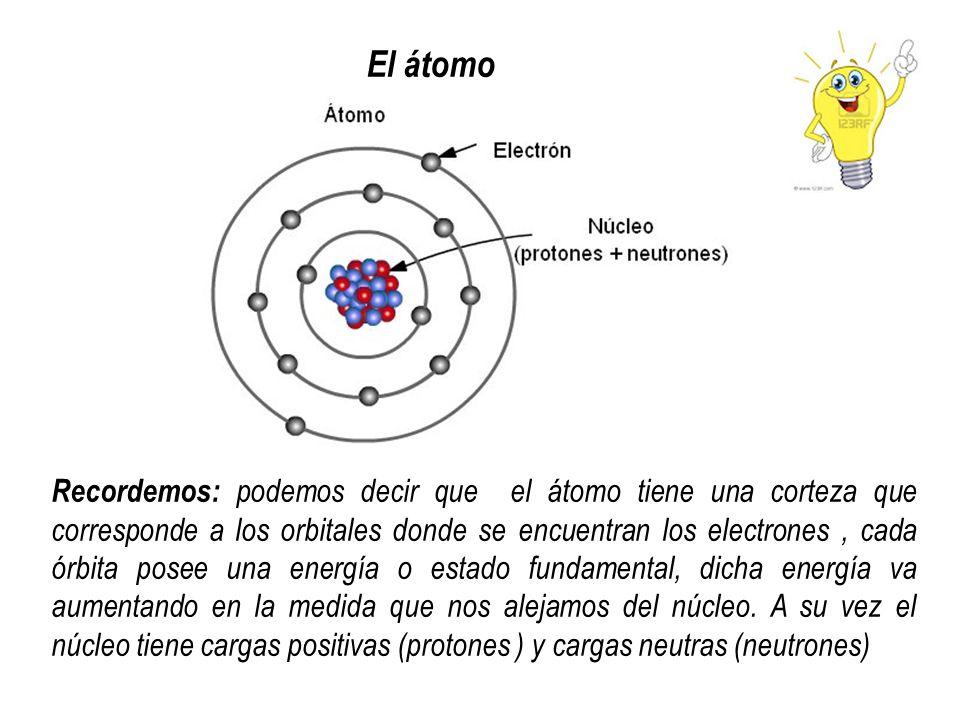
Los electrones, en cambio, giran alrededor del núcleo en órbitas definidas formando una nube de electrones que recibe el nombre de corteza electrónica. La corteza electrónica del átomo concentra toda la carga negativa y no tiene masa.
Órbitas de los electrones
Las órbitas que describen los electrones alrededor del núcleo atómico son órbitas predefinidas determinadas. Es decir, los recorridos de los electrones alrededor del núcleo atómico no son al azar. Dentro de la corteza electrónica existen solamente unas orbitas posibles para los electrones; mientras que otras órbitas están prohibidas. Se define como orbital atómico aquella zona alrededor del núcleo en que la probabilidad de encontrar un electrón es superior al 90%.
En cada uno de estos orbitales posibles el electrón que circula por él adquiere una energía determinada que aumenta conforme los orbitales se encuentran más alejados del núcleo. Los orbitales se agrupan en distintos niveles de energía (n) o capas, existen un total de 7 niveles de energía, siendo el n=1 el nivel de menor energía y el más próximo al núcleo del átomo. En cada uno de los niveles de energía o capa hay distintos tipos de orbitales (orbitales s, p, d y f)
La disposición en que se distribuyen los electrones en los distintos niveles de energía y orbitales en un átomo se conoce como configuración electrónica.

¿Cómo saber cuáles son los electrones de valencia?
Las características físicas y químicas de los átomos están definidas por su composición y, en especial, por la configuración electrónica de su capa más externa (capa de valencia).
Los elementos químicos son los distintos tipos de átomos que existen y vienen definidos por su número atómico (Z) y su número másico (A).
- Número atómico (Z): número de protones de un elemento atómico, que es igual al número de electrones si el átomo es neutro.
- Número másico (A): número de partículas con masa de un elemento atómico, es decir, la suma de las partículas del núcleo atómico (protones más neutrones).
Cada elemento tiene asignado un símbolo químico que lo representa y el conjunto de todos ellos se halla consignado en el documento científico que los ordena según su número atómico y los agrupa según sus características en familias y grupos de afines: la Tabla Periódica.

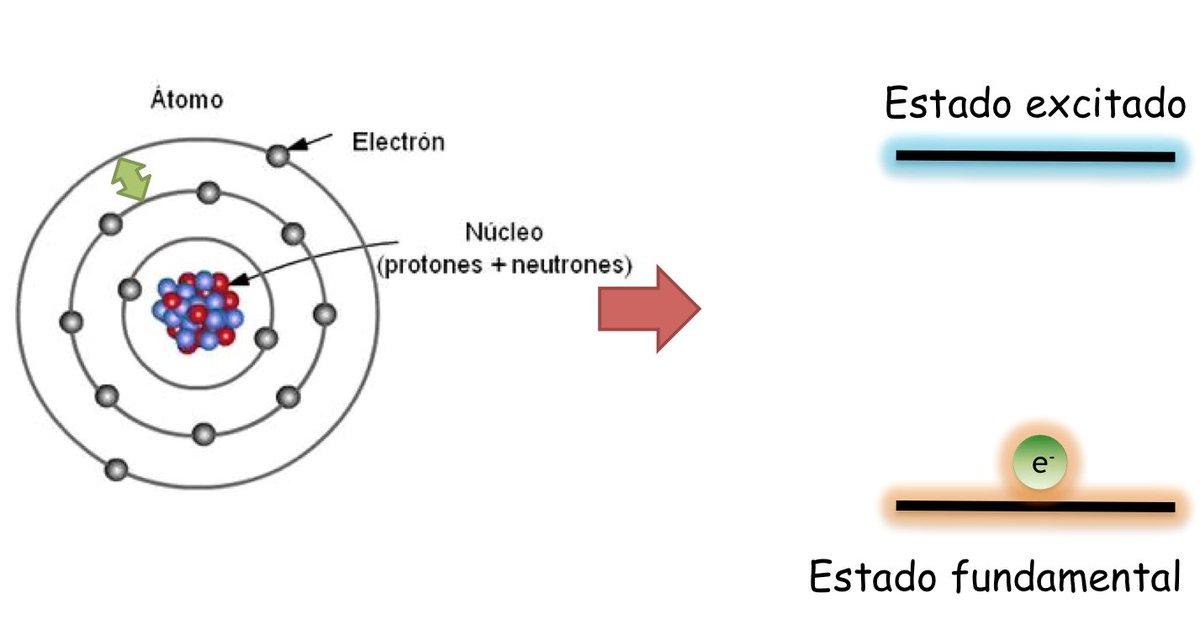
Electrones de un átomo: estado fundamental y en estado de excitación
En el estado fundamental, que se define como el estado de mínima energía y máxima estabilidad de un átomo; los electrones no se distribuyen al azar en los distintos orbitales atómicos, sino que ocupan los distintos orbitales de forma ordenada llenando siempre, en primer lugar, los orbitales libres de menor energía.
En este estado, el átomo tiene el mismo número de electrones que de protones y las cargas positivas y negativas se compensan entre sí, por tanto el átomo en conjunto es neutro (no tiene carga neta).
Sin embargo, los electrones pueden saltar de un orbital a otro desprendiendo o absorbiendo energía. Cuando los electrones de un átomo no llenan de forma ordenada los orbitales se dice que el átomo se encuentra en estado de excitación. En el estado de excitación uno o varios electrones ocupan orbitales de mayor energía dejando vacíos otros de energía menor. En estado de excitación los átomos son altamente inestables y tienden rápidamente a volver al estado fundamental.
Al cambiar de orbital el electrón emite o absorbe energía. Si el electrón salta de una órbita de menor energía a otra de mayor energía el átomo absorberá energía; mientras que si el salto se da en sentido contrario (de un orbital de mayor energía a uno de menor energía), el átomo desprenderá energía.

Pérdida o ganancia de electrones: formación de iones monoatómicos
Los electrones de la capa más externa de la corteza electrónica (llamada capa de valencia), son electrones que pueden abandonar el átomo o pueden ser incorporados por éste. De esta forma un átomo puede ganar o perder electrones.
En un átomo neutro el número de protones presentes en el núcleo es igual al de los electrones que componen su corteza electrónica. Es decir, el número de cargas positivas es igual al de cargas negativas. Cuando se produce ganancia o pérdida de electrones, los átomos forman iones monoatómicos.
Tipos de iones monoatómicos
Según la carga del ion se distinguen dos tipos:
- Cationes monoatómicos: átomos que han perdido uno o más electrones, de forma que parte de la carga positiva del núcleo no queda compensada. Por tanto el átomo adquiere carga neta positiva.
- Aniones monoatómicos: átomos que han ganado uno o más electrones de forma que el número de electrones es superior al de protones del núcleo de forma que el átomo adquiere carga neta negativa.

Electrones en movimiento: la corriente eléctrica
Cuando los electrones no están ligados a ningún átomo en particular se mueven por el espacio libre entre átomos. Este movimiento independiente de los electrones forma un flujo de carga eléctrica que puede desplazarse a través de ciertos materiales (materiales conductores y semiconductores).
Esto por ejemplo es lo que sucede en el caso de la corriente eléctrica que suministra energía a edificios, vehículos, etc.

Si deseas leer más artículos parecidos a Dónde se encuentran los electrones, te recomendamos que entres en nuestra categoría de El átomo.
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Química básica. Madrid: Uned