Estructura del átomo y características


Los átomos forman parte de nuestro mundo. Toda la materia está hecha de átomos, por eso, es importante conocer mejor en qué consisten y cuáles son sus funciones. En esta lección de unPROFESOR vamos a contarte cuál es la estructura del un átomo y características. Si quieres saber más sobre las partículas que forman toda la materia, sigue leyendo este artículo.
- ¿Qué son los átomos?
- Estructura del átomo
- Principales características del átomo
- ¿Cuáles son las partes de un átomo y sus características?
- ¿Qué son los isótopos?
- Las 3 partículas fundamentales del átomo
- ¿Cuántos niveles tiene un átomo y cuáles son sus características?
- ¿Cómo podemos caracterizar un átomo?
- ¿Cómo se encuentran los átomo en la naturaleza?
¿Qué son los átomos?
El átomo es la unidad más pequeña en la que se puede dividir la materia sin que pierda las propiedades químicas, es decir, sus propiedades como elemento químico. El átomo es el origen de todo aquello que se puede ver o tocar, desde las estrellas a tu desayuno de esta mañana.
Si dejamos de lado la perdida de sus propiedades químicas, podemos decir que el átomo está formado por diferentes partículas, denominadas partículas subatómicas. Hay tres tipos de partículas subatómicas -protones, neutrones y electrones- con diferentes características.
Estas partículas se agrupan en diferente número para formar los elementos químicos (el oxígeno, el carbono, etc.), pero siempre estarán distribuidos siguiendo una estructura fija.

Estructura del átomo
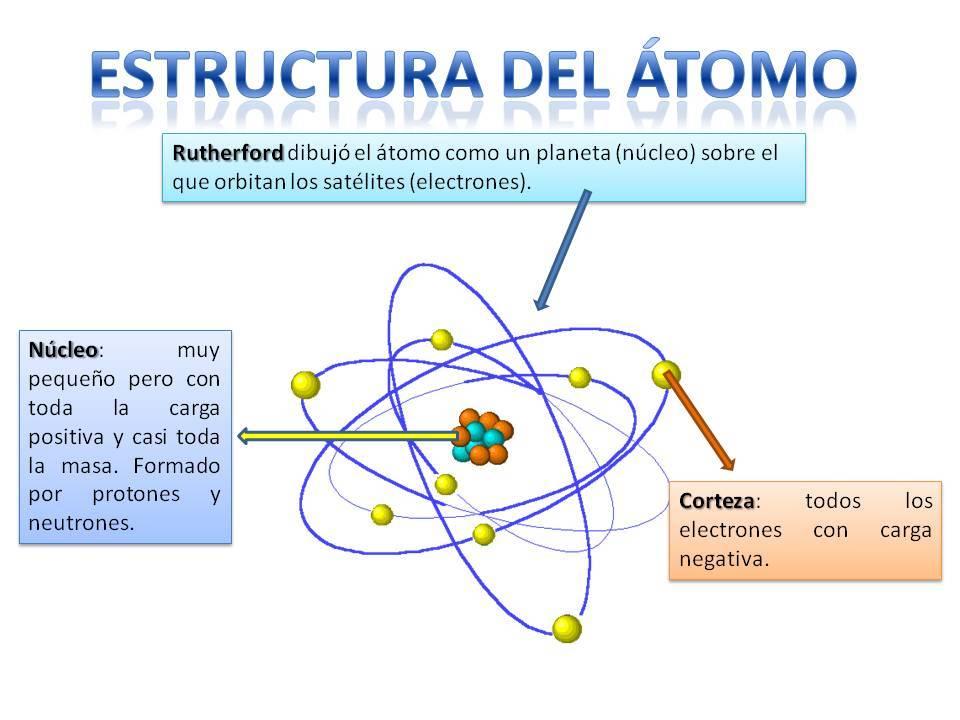
La estructura del átomo es fija, es decir, podemos tener diferentes tipos de átomos (el átomo de hidrógeno, el átomo de oxígeno, etc.) pero sus partículas subatómicas siempre se organizan de forma similar a un sistema planetario.
Seguro que recordarás como se organiza el sistema solar: el Sol se encuentra en el centro y alrededor de este giran los planetas describiendo diferentes órbitas, unas más cercanas y otras más lejanas al Sol. En el caso de los átomos, en el centro está el núcleo, con una forma similar a una mora y está compuesto por los neutrones y los protones.
Alrededor del núcleo esta la corteza que es la zona por la que giran u orbitan los electrones. Antiguamente se pensaba que los electrones describían unas determinadas orbitas, similar a como lo hacen los planetas, aunque ahora se sabe que estas órbitas no están tan bien definidas y son más bien como zonas en las que es más probable que nos encontremos a los electrones.

Principales características del átomo
Para continuar con esta lección sobre la estructura del átomo y características, es importante centrarnos en los elementos que hacen que un átomo sea considerado como tal.
Y para ello tenemos que responder a esta pregunta: ¿Por qué todos los átomos deciden ordenarse de esa determinada forma? La respuesta es sencilla: se debe a las fuerzas de atracción eléctrica. El núcleo del átomo está formado por los neutrones, que no tienen carga eléctrica y por los protones, que tienen carga eléctrica positiva y los electrones tienen carga eléctrica negativa, por lo que se produce una fuerza de atracción entre el núcleo y los electrones similar al que se producen entre los dos polos de un imán pero que no es lo suficientemente fuerte como para que los electrones “caigan” al núcleo.
Esto se entiende mejor si tenemos en cuenta el tamaño del núcleo: si el átomo tuviera, por ejemplo, la dimensión de un estadio de fútbol, el núcleo tendría la dimensión del balón en el centro del campo ¡Cuantísima fuerza de atracción tendría que hacer el balón de fútbol para que las gradas del estadio cayeran sobre él!
La función de los neutrones
Ahora te estarás preguntando, ¿y qué papel juegan los neutrones? A pesar de no tener carga eléctrica, los neutrones tienen un gran papel dentro del átomo: aportan un 99% de la masa. Si te ayuda a recordarlo podemos decir que un átomo es como una pandilla de tres amigos: el pesado neutrón, el positivo protón y el negativo electrón, que da vueltas y vueltas alrededor de neutrón y electrón.
El movimiento de los electrones
En este momento, quiero que volvamos a algo que habíamos dejado en el tintero: las órbitas que describen los electrones alrededor del núcleo. Habíamos dicho que los electrones giran alrededor del núcleo como lo hacen los planetas alrededor del Sol, unos más cerca que otros, ¿por qué lo hacen? Los electrones giran en una capa u otra según la energía que tienen para alejarse del núcleo, es decir, aquellos electrones que están más cerca del núcleo no tienen la fuerza suficiente para alejarse del núcleo mientras que los que están en capas (orbitales) más exteriores de la corteza tienen más energía y han podido alejarse más del núcleo. Además, en cada una de los orbitales hay una capacidad máxima de 8 electrones (regla del octeto).
Las partículas de un átomo
Vamos a volver a otro planteamiento que hemos hecho anteriormente pero no hemos explicado: los átomos están formados por neutrones, protones y electrones, que siempre se combinan siguiendo la misma estructura de núcleo y corteza, pero lo hacen en diferente número para formar los diferentes elementos químicos. ¿Cómo podemos conseguir esa cantidad elementos combinando solo 3 tipos de partículas? Los elementos químicos, que habrás visto alguna vez representados en la tabla periódica, se caracterizan por tener un determinado número atómico.
El número atómico (Z) nos indica el número de protones que hay en el núcleo de este tipo de átomos, que es igual al número de electrones en condiciones normales. Así, por ejemplo, todos los átomos que tienen 6 protones (Z=6) serán átomos de carbono, y tendrán las mismas propiedades químicas; los átomos con 5 protones (Z=5) serán átomos de boro, con iguales propiedades químicas entre sí y diferentes a las de los átomos de carbono. No tienes que confundir el número atómico con el peso atómico o número másico (A), que es la suma del peso de neutrones y protones (el peso de los electrones es despreciable respecto al peso del total del núcleo).

¿Cuáles son las partes de un átomo y sus características?
El átomo es la unidad básica de la materia, y aunque es muy pequeño, está compuesto por varias partes que cumplen funciones diferentes.
Un átomo está formado por dos zonas principales: el núcleo y la corteza electrónica.
- El núcleo es el corazón del átomo, una zona muy pequeña pero con mucha masa. Allí se encuentran dos tipos de partículas llamadas protones y neutrones. Los protones tienen carga eléctrica positiva (+), mientras que los neutrones no tienen carga, es decir, son neutros. Juntos, los protones y neutrones se conocen como nucleones.
- La corteza electrónica o nube de electrones que rodea al núcleo. En esta zona se encuentran los electrones, que son partículas muy pequeñas con carga negativa (−). Aunque tienen muy poca masa comparada con los protones y neutrones, los electrones son básicos porque determinan cómo interactúan los átomos entre sí, es decir, cómo forman enlaces químicos para crear moléculas.
¿Qué son los isótopos?
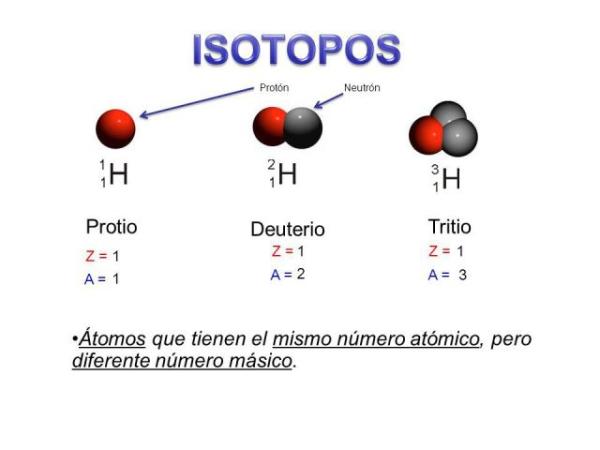
En la naturaleza podemos encontrar diferentes “subtipos” de elementos, los isótopos. Estoy segura de que en algún momento has escuchado hablar del carbono 14, un isótopo radioactivo del carbono que se utiliza para determinar, entre otras cosas, la edad de los fósiles. Los isótopos son dos átomos con el mismo número de protones (el mismo número atómico), pero diferente número de neutrones, (diferente masa atómica). Los isótopos de un mismo elemento suelen nombrarse con el nombre del elemento seguido de su masa atómica.
En nuestro ejemplo, ambos isótopos son de carbono, por lo que tienen un número atómico de 6 (Z=6) pero el carbono 12 (carbono “normal”) tiene un peso atómico de 12 frente al peso atómico de 14 del carbono 14. Los isótopos de un mismo elemento tienen unas propiedades químicas y físicas muy parecidas entre sí. En el caso del carbono 14, a diferencia del carbono 12, es un isótopo radioactivo que está presente en todos los elementos que contienen carbono, entre ellos los seres vivos.
Y con esto terminamos esta lección sobre la estructura del átomo y características. Esperamos que te haya servido de ayuda.
Las 3 partículas fundamentales del átomo
Las tres partículas principales que componen un átomo son protones, neutrones y electrones. Cada una tiene características que nos ayudan a definir el comportamiento y la identidad del átomo. Vamos a presentarte las 3 partículas una por una:
Protones (p⁺)
Estas son las características de los protones:
- Tienen carga positiva.
- Se encuentran en el núcleo del átomo.
- Su número define qué elemento químico es el átomo. Por ejemplo, todos los átomos con 6 protones son átomos de carbono, sin excepción.
- Cada protón tiene una masa de aproximadamente 1 uma (unidad de masa atómica).
- El número de protones también se llama número atómico (Z).
Neutrones (n⁰)
Estas son las características de los neutrones:
- No tienen carga eléctrica; son neutros.
- También están ubicados en el núcleo.
- Tienen una masa muy similar a la del protón, también cercana a 1 uma.
- Aunque no afectan la carga del átomo, sí influyen en su estabilidad. Si hay muchos o muy pocos neutrones en relación con los protones, el átomo puede volverse inestable (esto ocurre en los isótopos radiactivos).
Electrones (e⁻)
Estas son las características de los electrones:
- Tienen carga negativa.
- Se encuentran en constante movimiento en la corteza del átomo, en zonas llamadas orbitales o niveles de energía.
- Su masa es muy pequeña, unas 1.836 veces menor que la de un protón, por lo que su contribución a la masa total del átomo es prácticamente insignificante.
- Los electrones son los responsables de las reacciones químicas. Cuando los átomos se enlazan entre sí, lo hacen compartiendo o transfiriendo electrones.
Aquí te contamos dónde se encuentran los electrones.

¿Cuántos niveles tiene un átomo y cuáles son sus características?
Los electrones no se encuentran en cualquier lugar del espacio alrededor del núcleo. En realidad, ocupan zonas específicas llamadas niveles de energía o capas electrónicas. Estos niveles indican la distancia del electrón respecto al núcleo y la energía que posee.
Los niveles de energía se organizan en capas numeradas a partir del núcleo hacia fuera: nivel 1 (K), nivel 2 (L), nivel 3 (M), etc. Cada uno de estos niveles tiene una capacidad máxima de electrones, determinada por la fórmula: 2n², donde n es el número del nivel.
Así, cada nivel puede tener:
- Nivel 1: 2 electrones
- Nivel 2: 8 electrones
- Nivel 3: 18 electrones
- Nivel 4: 32 electrones
- ... y así sucesivamente.
Sin embargo, en la práctica, los elementos conocidos no suelen usar niveles tan altos, ya que los átomos más pesados tienen estructuras más complejas, con subniveles y orbitales que se solapan.
Los electrones llenan primero los niveles más cercanos al núcleo, es decir, los de menor energía. Solo cuando un nivel está completo, los electrones comienzan a llenar el siguiente.
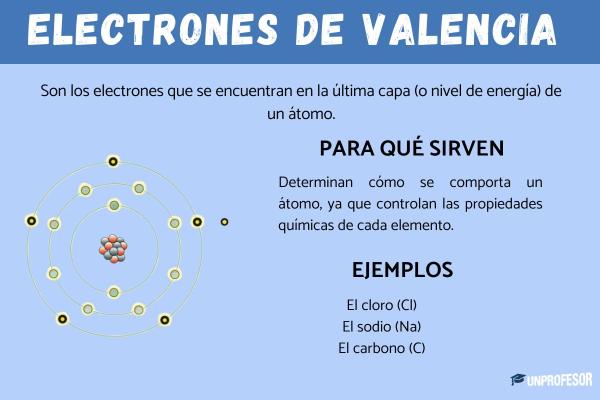
La capa de valencia, que es el nivel más externo que contiene electrones. Estos electrones de valencia son los que participan en los enlaces químicos. Por ejemplo, el oxígeno tiene 6 electrones en su capa de valencia, y por eso tiende a formar enlaces para completar 8 (la llamada “regla del octeto”).
Por último, no todos los átomos tienen el mismo número de niveles. El número de capas ocupadas por electrones depende de cuántos electrones tiene el átomo. Por ejemplo:
- El hidrógeno tiene solo un electrón, así que solo necesita el primer nivel.
- El sodio, con 11 electrones, usa tres niveles.
- El uranio, con 92 electrones, utiliza hasta siete niveles.
¿Cómo podemos caracterizar un átomo?
Para describir o caracterizar un átomo tenemos que definir cómo es y cómo se comporta. Para hacerlo, podemos usar los siguientes conceptos.
Número atómico (Z)
Es el número de protones que tiene un átomo en su núcleo. Este número determina el elemento químico. Por ejemplo, el oxígeno siempre tiene 8 protones, así que su número atómico es 8.
Número másico (A)
Es la suma de protones y neutrones en el núcleo. Aunque los electrones también forman parte del átomo, su masa es tan pequeña que no se considera aquí. Por ejemplo, si un átomo de oxígeno tiene 8 protones y 8 neutrones, su número másico es 16.
Configuración electrónica
Describe cómo están distribuidos los electrones en los distintos niveles y subniveles de energía. Esto nos permite entender cómo interactuará el átomo con otros. Por ejemplo, un átomo con una capa de valencia casi vacía tenderá a perder electrones (como los metales), mientras que uno con la capa casi llena tenderá a ganarlos (como los no metales).
Estado de ionización
Un átomo puede ganar o perder electrones y convertirse en un ion. Si pierde electrones, se convierte en un catión (positivo). Si los gana, en un anión (negativo). Este estado afecta cómo se combina con otros átomos.
Isótopos
Son átomos de un mismo elemento (mismo número atómico) pero con diferente número de neutrones, y, por tanto, distinto número másico. Algunos isótopos son estables, pero otros son inestables o radiactivos. Por ejemplo, el carbono tiene dos isótopos estables (C-12 y C-13) y uno radiactivo (C-14), que se utiliza en la datación de fósiles.
Radio atómico
Es el tamaño aproximado del átomo, es decir, la distancia entre el núcleo y el electrón más externo. Este valor puede variar dependiendo del entorno químico del átomo.
Electronegatividad y energía de ionización
La electronegatividad es la capacidad de un átomo para atraer electrones cuando forma un enlace. La energía de ionización es la cantidad de energía necesaria para quitar un electrón al átomo.
¿Cómo se encuentran los átomo en la naturaleza?
Los átomos pueden encontrarse de forma aislada, pero lo más normal es encontrarlos combinados en grupos llamados moléculas.
Las moléculas pueden estar formadas por átomos del mismo elemento (como la molécula de oxígeno, formada por dos átomos de oxígeno) o por grupos con átomos de diferentes elementos (dos átomos de hidrógeno y uno de oxígeno forman la molécula de agua). Estos grupos de elementos se denominan moléculas, que a su vez pueden ir combinándose entre sí y formando diferentes agrupaciones más y más complejas según su reactividad y su afinidad química por medio de enlaces químicos.
Si deseas leer más artículos parecidos a Estructura del átomo y características, te recomendamos que entres en nuestra categoría de El átomo.
- Moreno, P. A. L., & Nieves, J. D. P. (2019). Realidad aumentada (RA), una alternativa y estrategia para la enseñanza de la estructura del átomo. Bio-grafía, 2017-2022.
- Alvarado Zamorano, C. (2005). La estructura atómica y el enlace químico desde un punto de vista disciplinario. Enseñanza de las ciencias, (Extra), 1-5.